2010
| News | Registration | Abstracts | Accommodation | Excursions | Deadlines | Organizing committee |
| First circular | Participants | Abstract submission | Travel | Program | Seminar History | Contact us |
| Новости |
| Первый циркуляр |
| Регистрация |
| Оформление тезисов |
| Тезисы |
| Программа |
| Участники |
| Размещение |
| Экскурсии |
| Проезд |
| Важные даты |
| Оргкомитет |
| Обратная связь |
Синтетические аналоги гидроталькита и возможности их применения.
Гредина И.В.*, Кулюхин С.А.**, Красавина Е.П.**
* Институт геологии и аналитической химии им. Вернадского, Москва, Россия; ** Институт физической химии и электрохимии им. Фрумкина, Москва, Россия
В последнее время человек оказывает на природу отрицательное воздействие и производит изменения естественного радиационного фона: извлекается большое количество радионуклидов попутно с полезными ископаемыми (уголь, нефть, фосфориты и др.); производится глобальное загрязнение поверхности Земли радионуклидами в результате испытания ядерного оружия и Чернобыльской аварии; допускается локальное загрязнение окружающей среды вокруг радиохимических заводов, АЭС, урановых рудников, заводов по переработке урановой руды и т.д. Одной из наиболее актуальных экологических проблем современности в области промышленного использования атомной энергии является очистка значительных количеств жидких радиоактивных отходов (ЖРО), получающихся при эксплуатации ядерных энергетических установок различного назначения, при переработке отработанного ядерного топлива (ОЯТ), при утилизации различных устройств и техники, загрязненных радиоактивными веществами, а также при решении других технологических задач, связанных с использованием радиоактивных излучений. Для извлечения радионуклидов из ЖРО широкое применение находят различные сорбенты как природные (торф, песчаник, трепел, цеолиты, различные угли, минералы и т.д.), так и синтетические (органические ионообменники, полимеры, импрегнированные различными металлами силикагели и цеолиты, неорганические соли и т.д.). При этом в процессах переработки ЖРО все большее применение находят неорганические сорбенты. Они в отличие от органических ионообменников обладают более высокой механической прочностью, химической и радиационной устойчивостью, многие имеют невысокую стоимость. После использования в процессах очистки их вместе с накопленными радионуклидами возможно отправлять на захоронение в виде твердых радиоактивных отходов в составе различных матриц (цемент, битум, стекло).
Несмотря на широкое применение различных сорбентов в процессах извлечения радионуклидов из ЖРО, не существует универсального сорбента, позволяющего проводить одновременное извлечение радионуклидов, присутствующих в растворе как в виде катионов, так и анионов. Для каждой химической формы используются либо катионообменные, либо анионообменные материалы. При этом часто наличие в ЖРО комплексообразующих лигандов значительно снижает эффективность сорбции применяемых сорбентов по отношению к тому, или иному радионуклиду.
В природе существуют различные минералы, имеющие в своем составе одновременно катион- и анионобменные группировки, т.е. способные одновременно выступать как катионо-, так и анионообменные материалы. К таким материалам относятся слоистые двойные гидроксиды (СДГ), которые являются аналогами природного минерала гидроталькита. Месторождения гидроталькита есть в России, Канаде, США, Норвегии, Швеции, Австралии, Франции, Германии, Чешкой Республике и т.д.: Ковдорский массив щелочно-ультраосновных пород и карбонатитов (Кольский полуостров), Хибины (Кольский полуостров), Лонгбан (Швеция), Палабора (Южная Африка) и др.
Слоистые двойные гидроксиды (СДГ) представляют собой соединения состава: [M2+1-x M3+x (OH)2 [(Anionn-) x / n ּ mH2O], где М2+ и М3+ - катионы в степенях окисления 2+ и 3+ соответственно, а Anionn- - практически любой анион или анионный комплекс. Являясь аналогами природного минерала гидроталькита и обладая слоиcтой структурой с положительно заряженными гидроксидными слоями [M2+1-x M3+x (ОН)2]х+ и анионами, находящимися в межслоевом пространстве. К настоящему времени получены СДГ с различными двух- и трехвалентными металлами, а также различными анионами в своем составе. Для получения СДГ с различными анионами в межслоевом пространстве используют следующие методы: 1) соосаждение в присутствии заданного аниона, позволяющее получить СДГ, содержащие только один тип анионов в межслоевом пространстве; 2) прямой обмен анионов; 3) взаимодействие раствора содержащего определенный Anionn-, с твёрдой фазой СДО; 4) «расплавный» метод.
Элементарная ячейка гидроталькита образована бруситоподобными слоями Mg(OH)2. Катионы магния в слое брусита окружены шестью атомами кислорода, а межслоевое взаимодействие осуществляется за счет водородных связей. Что касается двойных гидроксидов, то замещение части двухвалентных катионов катионами иной зарядности приводит к возникновению в слоях положительного заряда, который компенсируется анионами, расположенными в межслоевом пространстве.
Структура СДГ в целом стабильна за счет электростатического взаимодействия между положительно заряженными гидроксидными слоями и межслоевыми анионами, несущими отрицательный заряд. Подавляющее большинство СДГ кристаллизуется в тригональной (ромбоэдрической) сингонии. Одним из важнейших свойств СДГ является устойчивость их слоистой структуры в широком диапазоне изменения размеров катионов и анионов. Получены образцы магний-алюминиевых СДГ (СДГ-Mg-Al), содержащие в межслоевом пространстве разнообразные анионы с размерами от 0.3 до 5 нм.
Другим важным свойством является термостабильность СДГ. Термическое разложение СДГ протекает с сохранением их слоистой структуры. Это позволяет проводить химические реакции с их участием при повышенных температурах практически без разрушения матрицы, ограничивающей реакционную зону.
В данной работе были синтезированы соединения гидроталькитного ряда. Карбонатную форму СДГ-Mg-Al-CO3 (гидроталькит) синтезировали методом осаждения из раствора нитратов магния и алюминия (Mg : Аl = 3 : 1, общая концентрация катионов составляла 1 М) раствором карбоната и гидроксида натрия ([СО32-] : [ОН-] = 1 : 6, общая концентрация анионов - 3 М) по реакции:
3Mg2+ + Al3+ + 6OH- + ½ (CO3)2- + mH2O→Mg3Al(OH)3(CO3)1/2.mH2O
При проведении синтеза СДГ-Mg-Al-CO3 в реактор приливали при перемешивании растворы нитратов алюминия и магния и одновременно прикапывали раствор осадителя. Осадок выдерживали в маточном растворе при 80оС в течение 72 ч. Затем осадок отделяли центрифугированием, высушивали на воздухе при температуре 100-120оС, многократно промывали водой и вновь высушивали.
Синтез СДГ-Mg-Nd-CO3, а также смешанных СДГ-Mg-Al-Nd-CO3 с различным отношением Al3+ : Nd3+ проводили по той же самой методике. Наряду с карбонатной формой СДГ-Mg-Al-CO3 были синтезированы образцы СДГ-Mg-Al, содержащие в своем составе NO3- и H2ЭДТА2- ионы.
Для синтезированных соединений были получены порошковые рентгенограммы на дифрактометре АДП-10 фирмы «Филипс» с излучением СиКα, также были проведены термогравиметрические анализы с использованием дериватографа марки Q-1500 фирмы «МОМ» (Будапешт, Венгрия). Нагревание образцов проводили в Pt тиглях в атмосфере воздуха со скоростью 10оС/мин. (рис. 1).
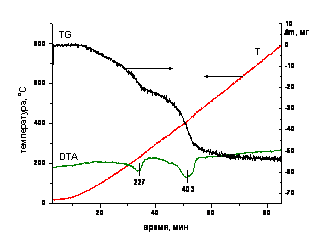
Рис. 1. Данные термогравиметрического анализа СДГ-Mg‑Al‑CO3
(масса навески - 119.7 мг)
Благодаря возможности приспособления различных катионов в бруситоподобных слоях, возможности интеркаляции нескольких типов анионов в межслоевое пространство, слоистые двойные гидроксиды могут применяться для катализа, ионного обмена, фармацевтики и фотохимии. Особый интерес вызывает применение СДГ в качестве геохимических барьеров для локализации радионуклидов.
Ссылки:
Третьяков Ю.Д., Лукашин А.В., Елисеев А.А. // Успехи химии. 2004. Т. 73, № 9. С. 974 - 998.
Кулюхин С.А., Красавина Е.П., Румер И.А. и др. // Радиохимия. 2007. Т. 49, № 5. С. 437 - 441.